Khí H2S là một chất khí quen thuộc trong nhiều ngành công nghiệp. Nhưng H2S Là Gì và tại sao nó lại được cảnh báo là gây độc? Hãy cùng VIETCHEM khám phá mọi điều về khí H2S, từ cấu tạo, tính chất đến ứng dụng và cách điều chế trong bài viết sau.
1. Định Nghĩa và Cấu Trúc Khí H2S
Vậy khí H2S là gì? Khí H2S, hay còn gọi là hydro sunfua, là một hợp chất hóa học có công thức phân tử H2S. Nó dễ dàng được nhận biết bởi mùi đặc trưng.
Về cấu trúc, H2S tương tự như phân tử nước (H2O), gồm hai nguyên tử hydro (H) liên kết với một nguyên tử lưu huỳnh (S). Nguyên tử lưu huỳnh nằm ở trung tâm, liên kết với hai nguyên tử hydro bằng liên kết đơn.
 cau-tao-khi-h2s
cau-tao-khi-h2s
Độ âm điện của lưu huỳnh không lớn như oxy, do đó H2S ít phân cực hơn nước. Điều này dẫn đến lực liên phân tử yếu và điểm sôi, điểm nóng chảy thấp hơn so với nước.
H2S hình thành chủ yếu do vi sinh vật phân hủy chất hữu cơ trong điều kiện thiếu oxy (phân hủy kỵ khí). Nó cũng có mặt trong khí núi lửa, dầu thô, khí tự nhiên và một số nguồn nước giếng, suối nước nóng. Thậm chí, cơ thể người cũng tạo ra một lượng nhỏ H2S để làm phân tử truyền tín hiệu.
2. Tính Chất Lý Hóa Đặc Trưng Của H2S
Để hiểu rõ hơn H2S là gì, hãy cùng tìm hiểu về các tính chất lý hóa đặc trưng của nó:
2.1. Tính Chất Vật Lý Của Khí H2S
- Mùi: Mùi trứng thối đặc trưng, rất dễ nhận biết.
- Trạng thái: Chất khí, dễ cháy.
- Điểm sôi: -60 độ C (thấp hơn nhiều so với nước, 100 độ C).
- Độ tan: Nặng hơn không khí một chút, tan được trong nước và dung môi hữu cơ.
- Độc tính: Khí độc, không màu, hít phải lượng nhỏ có thể gây đau đầu.
- Tính dẫn điện: Ở áp suất rất cao (trên 90 GPa), H2S trở thành chất dẫn điện kim loại.
2.2. Tính Chất Hóa Học Của Khí H2S
-
Tính axit yếu:
-
Làm giấy quỳ tím chuyển đỏ.
-
Phản ứng với dung dịch kiềm tạo muối trung hòa và nước:
- H2S + NaOH → NaHS + H2O
- H2S + 2NaOH → Na2S + H2O
-
Phản ứng với dung dịch muối cacbonat tạo muối trung hòa và nước:
- H2S + Na2CO3 → NaHCO3 + NaHS
-
-
Tính khử mạnh: H2S là chất khử mạnh, đặc biệt khi có mặt bazơ tạo ra SH-.
-
Hỗn hợp H2S và không khí có thể gây nổ:
- 2H2S + 3O2 → 2H2O + 2SO2
-
Phản ứng với kim loại tạo muối sunfua kim loại không tan (thường có màu sẫm):
- 2H2S + 2K → 2KHS + H2
-
Phản ứng với Ag tạo muối sunfit:
- 4Ag + 2H2S + O2 → 2Ag2S + 2H2O
-
Bị oxy hóa khi phản ứng với Clo tạo thành H2SO4 (khi có nước):
- 4Cl2 + H2S + 4H2O → H2SO4 + 8HCl
-
3. Các Phương Pháp Điều Chế Khí H2S
Vậy H2S được điều chế như thế nào? Dưới đây là một số phương pháp điều chế khí H2S:
3.1. Điều Chế H2S Trong Phòng Thí Nghiệm
-
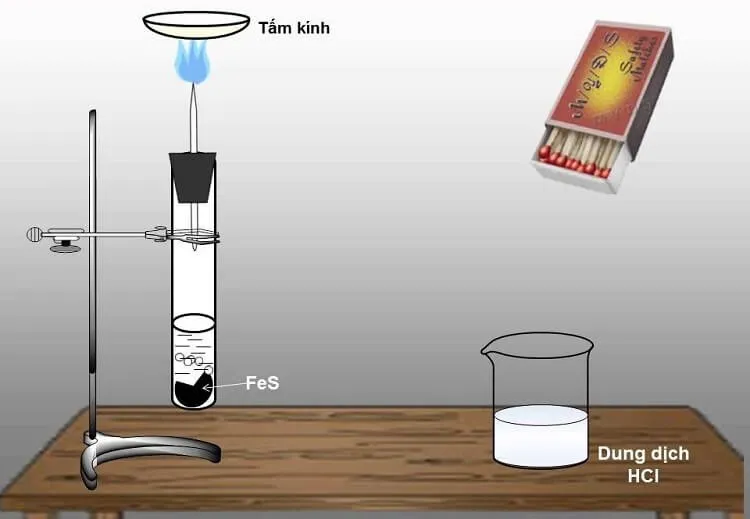
Phản ứng giữa sắt sunfua và axit mạnh trong bình Kipp:
- FeS + 2 HCl → FeCl2 + H2S
-
Sunfua kim loại hoặc phi kim tác dụng với nước:
- 6 H2O + Al2S3 → 3 H2S + 2Al(OH)3
-
Phân tích Thioacetamide:
- CH3C(S)NH2 + H2O → CH3C(O)NH2 + H2S
 dieu-che-khi-h2s
dieu-che-khi-h2s
3.2. Điều Chế H2S Trong Công Nghiệp
- Tách H2S từ “khí chua” (khí tự nhiên có hàm lượng H2S cao) là phương pháp phổ biến nhất.
- Cho S nguyên tố nóng chảy tác dụng với H2 ở khoảng 450 độ C.
- Vi khuẩn khử sunfat oxy hóa các hợp chất hữu cơ hoặc H2 trong điều kiện oxy thấp.
4. Mức Độ Độc Hại Của Khí H2S
Một trong những vấn đề được quan tâm hàng đầu về H2S là gì, chính là độc tính của nó. Khí H2S là một loại khí độc vì:
- Tính dễ nổ: Dễ gây nổ và tạo thành các khí độc hại khác như SO2.
- Ảnh hưởng sức khỏe:
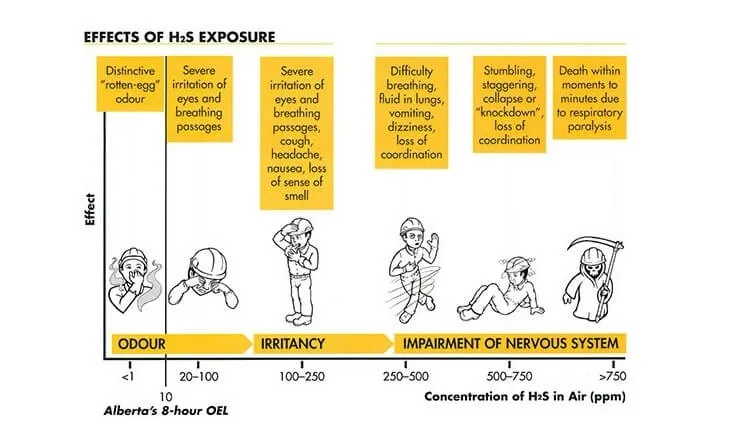
- Nồng độ thấp: Kích ứng mũi, họng, mắt, buồn nôn, khó thở, đau đầu, giảm trí nhớ, mệt mỏi, mất cân bằng. Người có bệnh hen suyễn có thể cảm thấy khó thở hơn.
- Nồng độ cao (trên 1000 ppm): Bất tỉnh, tổn thương vĩnh viễn hoặc lâu dài như đau đầu, giảm tập trung, chóng mặt, trí nhớ kém, rối loạn chức năng vận động.
 trieu-chung-nhiem-doc-cua-khi-h2s
trieu-chung-nhiem-doc-cua-khi-h2s
5. Ứng Dụng Đa Dạng Của Khí H2S Trong Đời Sống và Sản Xuất
Vậy khí H2S có những ứng dụng gì? H2S được ứng dụng trong nhiều ngành:
- Hóa học phân tích: Phát hiện các cation.
- Sản xuất hóa chất: Tiền thân của lưu huỳnh nguyên tố (S), H2SO4, methanethiol, ethanethiol, axit thioglycolic…
- Điều chế sunfua kim loại: Ứng dụng trong ngành sơn.
- Tách nước nặng (deuterium oxide): Thông qua quá trình Girdler sulfide.
- Nông nghiệp: Chất khử trùng.
- Y tế: Nghiên cứu cho thấy một lượng nhỏ khí H2S có thể giúp ngăn ngừa tổn thương ty thể.
- Gia công kim loại: Thành phần trong một số loại dầu cắt, chất làm mát và chất bôi trơn.
Hy vọng bài viết này đã giúp bạn hiểu rõ hơn H2S là gì, tính chất, ứng dụng và những lưu ý quan trọng khi tiếp xúc với khí H2S. Nếu bạn có bất kỳ thắc mắc nào, đừng ngần ngại liên hệ với VIETCHEM để được giải đáp.
Có thể bạn quan tâm
- Ai là người tạo ra Trái Đất?
- PTE Academic là gì? Thông tin đầy đủ và chi tiết nhất cho người mới bắt đầu năm 2024
- Nổ Hũ Giao Diện Đẹp – Khám Phá Sự Kết Hợp Giữa Nghệ Thuật và Trò Chơi
- Anime Boy Hình Ảnh Ngầu Nhất: Tổng Hợp Cho Fan Hâm Mộ
- Cân bằng phương trình hóa học Cl2 + NaOH
- 0218 Là Mạng Gì? Giải Đáp Chi Tiết Về Đầu Số Cố Định Này
- Hướng Dẫn Cách Vẽ Áo Dài Đơn Giản
- 26/4 Là Ngày Gì? Tìm Hiểu Về Ngày Sở Hữu Trí Tuệ Thế Giới
- Hình Xăm Gia Đình 3 Người: Ý Nghĩa và Gợi Ý
- Quản Trị Là Gì? Định Nghĩa, Bản Chất Và Các Khái Niệm Liên Quan
