Trong ngành hóa học, axit cacbonic là một hợp chất vô cơ hấp dẫn và có nhiều ứng dụng trong tự nhiên cũng như đời sống hàng ngày. Vậy H2CO3 đọc Là Gì và những điều thú vị nào loài người đã khám phá ra về nó? Hãy cùng THPT Hồng Ngự 1 tìm hiểu chi tiết qua bài viết dưới đây.
1. Axit Cacbonic Là Gì?
Axit cacbonic, ký hiệu hóa học là H2CO3, là một chất lỏng không màu được tạo ra khi khí CO2 hòa tan trong nước. Dù là một axit rất yếu, axit cacbonic đóng vai trò quan trọng trong nhiều quá trình hóa học và sinh học tự nhiên. Công thức hóa học của nó là: H2CO3.
- Khối lượng phân tử: 62,03 g/mol
Axit cacbonic được phát hiện lần đầu trong nước khoáng, nhờ vào vị chua của nó. Năm 1597, nó được Andreas Libavius và sau đó Johan Baptista van Helmont ghi nhận trong những nghiên cứu chi tiết về quá trình chuyển hóa hóa học.
2. Tính Chất Của Axit Cacbonic
2.1. Trạng Thái Tự Nhiên
Axit cacbonic có mặt ở nhiều nơi như đá vôi, hang động, nước mưa và đại dương. Bên cạnh đó, cơ thể con người cũng chứa axit cacbonic, trong đó CO2 trong máu kết hợp với nước và sau đó được thở ra dưới dạng khí. Nó có trong nhiều loại đồ uống có gas như cola.
 Axit cacbonic trong nước mưa
Axit cacbonic trong nước mưa
2.2. Tính Chất Hóa Học
Là một axit yếu, axit cacbonic làm đổi màu quỳ tím sang đỏ nhạt nhưng không bền, dễ phân hủy thành CO2 và nước theo phản ứng:
H2CO3 → CO2 + H2O
Do tính chất lưỡng cực, axit này có thể tạo ra muối carbonate và bicarbonate.
3. Phương Pháp Điều Chế Axit Cacbonic
Axit cacbonic được điều chế đơn giản bằng cách hòa tan CO2 trong nước:
H2O + CO2 → H2CO3
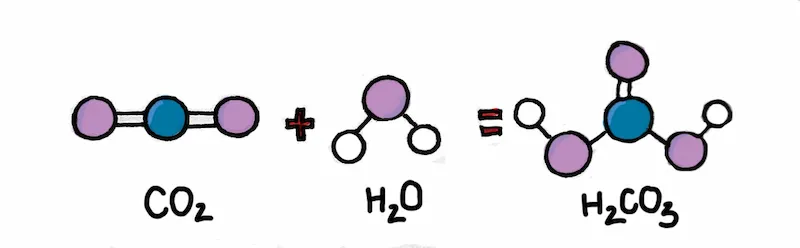 Điều chế axit cacbonic
Điều chế axit cacbonic
4. Ứng Dụng Của Axit Cacbonic
Axit cacbonic đóng góp vào quá trình hình thành các đặc điểm tự nhiên và sản phẩm tiêu dùng:
- Tự nhiên: Hòa tan đá vôi, tạo ra canxi bicarbonat và các hình thái đá vôi độc đáo như măng đá.
- Đời sống: Thành phần chính trong đồ uống có gas, thức ăn lên men, đóng góp vào vị và chất vi sinh có lợi.
- Các ứng dụng khác: Dược phẩm, mỹ phẩm, nông nghiệp và nhiều lĩnh vực khác.
5. Bài Tập Về Axit Cacbonic
Ví Dụ
Khẳng định rằng H2CO3 yếu hơn HCl và không bền:
- Phản ứng: 2HCl + Na2CO3 → 2NaCl + H2CO3
- H2CO3 nhanh chóng phân hủy: H2CO3 → CO2 ↑ + H2O
Hy vọng qua bài viết này, bạn đã hiểu rõ và trả lời được câu hỏi “H2CO3 đọc là gì?” một cách đầy đủ. Đừng quên ghé thăm website của THPT Hồng Ngự 1 để khám phá nhiều thông tin bổ ích khác trong môn Hóa học.
Có thể bạn quan tâm
- 0218 Là Mạng Gì? Giải Đáp Chi Tiết Về Đầu Số Cố Định Này
- Hwarang là gì? Khám phá về Hwarang và vai trò của họ trong lịch sử Hàn Quốc
- Gheorghe Hagi – biểu tượng bóng đá Romania và những khoảnh khắc vàng son
- Đăng Nhập Go88 Dễ Dàng Chỉ Trong Vài Bước Đơn Giản Nhất
- Nhà cái Bet88 – Cổng game uy tín và chất lượng cho người chơi
- Cách cân bằng giữa công việc và Game online giải trí
- Điều Chế CH4 Từ CH3COONa: Phương Trình Và Ứng Dụng
- 18/6 Là Cung Gì? Giải Mã Vận Mệnh, Tính Cách Người Sinh Ngày 18 Tháng 6
- Ái Nhi Là Gì? Tìm Hiểu Về Khái Niệm Và Nguồn Gốc
- Nhảy Mũi Là Điềm Gì? Giải Mã Ý Nghĩa Hiện Tượng Nhảy Mũi Theo Tâm Linh Và Khoa Học
