Anken, còn được biết đến với tên gọi Olefin, là các hidrocacbon không no có cấu trúc mạch hở với ít nhất một liên kết đôi C=C trong phân tử. Đây là một phần quan trọng trong hóa học hữu cơ, đặc biệt là trong quá trình tổng hợp các hợp chất hữu cơ khác.
Anken rất phổ biến trong tự nhiên và cũng được ứng dụng rộng rãi trong sản xuất công nghiệp. Trong bài viết này, chúng ta sẽ tìm hiểu chi tiết về đặc điểm cấu tạo, cách gọi tên, tính chất vật lý và hóa học của Anken.
Công thức cấu tạo và cách gọi tên của Anken
Công thức tổng quát
Anken có công thức tổng quát là CnH2n, trong đó “n” là số nguyên dương biểu thị số nguyên tử cacbon trong phân tử. Công thức này giúp tính toán số nguyên tử hydro và xác định tính chất của anken.
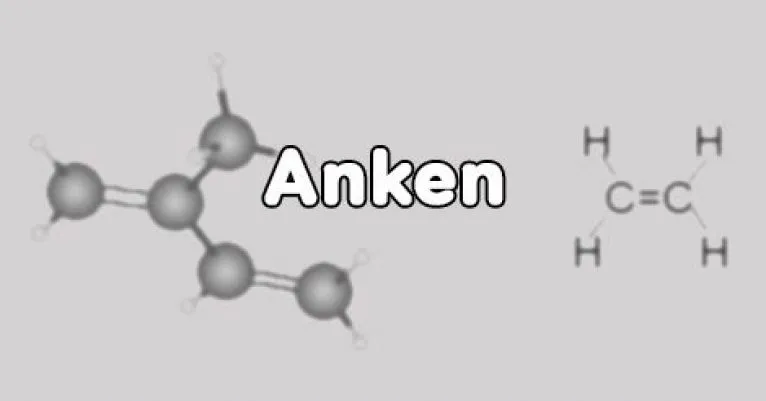 Minh họa Anken
Minh họa Anken
Cách gọi tên các Anken
Có hai cách gọi tên anken chủ yếu là tên thông thường và tên thay thế.
Tên thông thường
Tên thông thường thường là từ gốc của Ankan tương ứng nhưng thay đuôi “-an” thành “-ilen”. Ví dụ, etilen (CH2=CH2).
Tên thay thế
Tên thay thế được đọc theo thứ tự: số vị trí nhánh – tên nhánh – số vị trí liên kết đôi – “en”. Ví dụ, But-1-en cho CH2=CH-CH2-CH3.
Bạn có thể tìm hiểu thêm về ancol để có cái nhìn đa dạng hơn về hóa học hữu cơ.
Tính chất vật lý của Anken
- Dạng vật lý thay đổi từ khí đến lỏng và rắn khi số nguyên tử cacbon tăng.
- Anken nhẹ hơn nước và ít tan trong nước nhưng hòa tan tốt trong dung môi hữu cơ như rượu, ete.
- Nhiệt độ sôi, khối lượng riêng và nhiệt độ nóng chảy tăng khi tăng số nguyên tử trong mạch cacbon.
Tính chất hóa học của Anken
Phản ứng cộng
Anken tham gia vào nhiều phản ứng cộng khác nhau, trong đó các phản ứng quan trọng gồm cộng hydro (H2), halogen (Br2, Cl2), hidro halogen (HCl, HBr) và nước.
Phản ứng trùng hợp
Anken có khả năng trùng hợp để tạo ra các polyme như polyethylen (PE) và polypropylen (PP).
Phản ứng oxi hóa
Anken có thể bị oxi hóa không hoàn toàn hoặc hoàn toàn, làm mất màu dung dịch thuốc tím (KMnO4) và có thể giải phóng khí CO2 khi bị đốt cháy.
Điều chế Anken
Trong phòng thí nghiệm
Anken thường được điều chế bằng phương pháp tách nước từ ancol etylic hoặc tách HX từ dẫn xuất halogen.
Trong công nghiệp
Anken cũng được sản xuất với quy mô lớn từ khí thiên nhiên và quá trình cracking dầu mỏ.
Ví dụ và ứng dụng
Anken có nhiều ứng dụng trong sản xuất chất dẻo và là nguyên liệu cho các phản ứng hữu cơ khác. Hiểu rõ về anken, bạn sẽ dễ dàng hơn trong việc dự đoán các sản phẩm hóa học.
Kết luận
Công thức phân tử tổng quát của anken CnH2n giúp giải thích nhiều tính chất và phản ứng của loại hợp chất này trong hóa học. Anken không chỉ là chủ đề quan trọng trong việc học hóa mà còn là nền tảng cho nhiều ngành công nghiệp lớn. Để nắm bắt sâu hơn, hãy tham khảo các tài liệu từ THPT Hồng Ngự 1 để củng cố kiến thức về anken và các hợp chất liên quan.
Có thể bạn quan tâm
- 1 m bằng bao nhiêu cm – Khám phá cách đo lường trong cuộc sống hàng ngày
- An Dương Vương Đặt Quốc Hiệu Nước Ta Là Gì?
- Game Blockchain là gì? Khám phá thế giới game trên nền tảng công nghệ chuỗi khối
- Ngủ mơ thấy người yêu cũ số mấy? Giải mã giấc mơ cũ để tìm con số mới
- Bí Quyết “Vàng”: Cách Làm Đàn Ông Say Đắm Bạn Mãi Mãi
- Ai là Tác Giả Chiếu Dời Đô?
- Hình Ảnh Chúa Giêsu: Niềm Hy Vọng Và Tình Yêu Thương Vô Điều Kiện
- Bệnh Cây Là Gì? Tìm Hiểu Về Cây Mật Gấu Và Công Dụng Chữa Bệnh
- Sự phát triển của đồ họa 3D trong các trò chơi thám hiểm đại dương trên di động
- Flexin là gì? Giải mã hiện tượng Flexin trong giới trẻ
